Qu’est-ce que les BPL ?
Les bonnes pratiques de laboratoire (BPL) sont un système de qualité couvrant le processus organisationnel et les conditions dans lesquelles les études non cliniques en laboratoire sont planifiées, réalisées, contrôlées, enregistrées, rapportées et archivées. Les BPL garantissent la qualité et l’intégrité des données de tests de sécurité soumises au gouvernement pour la délivrance de permis de recherche.
Différences entre BPF et BPL
La différence entre les BPF et les BPL se retrouve dans leur champ d’application. Les bonnes pratiques de fabrication s’appliquent à l’ensemble du processus de fabrication des médicaments, tandis que les bonnes pratiques de laboratoire ne s’appliquent qu’à la phase des tests de sécurité. Les BPF et les BPL sont tous deux appliqués par la Food and Drug Administration (FDA) aux États-Unis.
Devez-vous vous conformer aux BPL ?
Vous trouverez ci-dessous un tableau basé sur les directives de la FDA pour aider les laboratoires de recherche à déterminer si une étude ou une activité spécifique doit être conforme aux bonnes pratiques de laboratoire :
|
Conformité aux BPL requise |
Conformité aux BPL non requise |
|
|
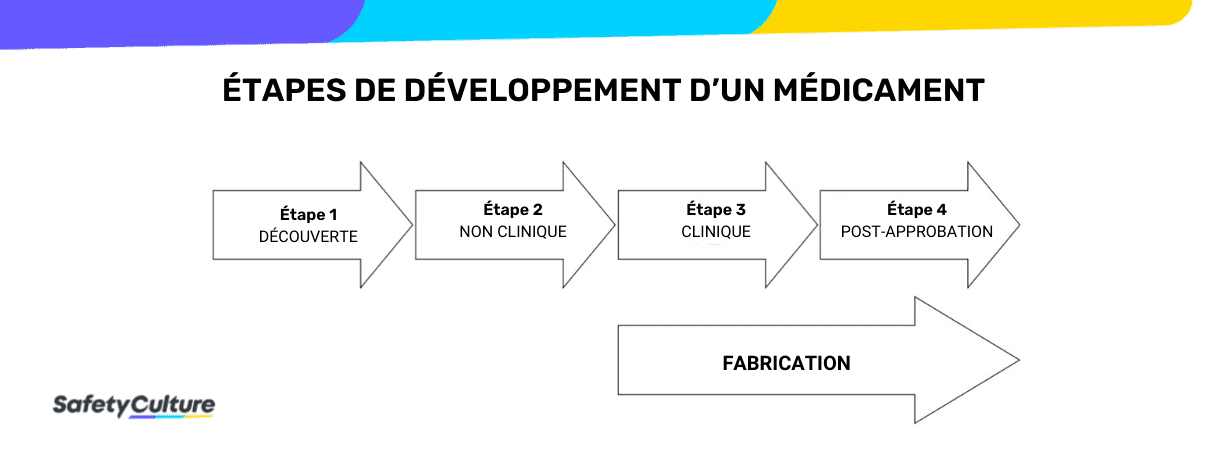
Les BPL ne sont pas non plus nécessaires pendant les premières étapes du développement, telles que la découverte, le dépistage, la recherche fondamentale et l’évaluation du concept. Selon l’Organisation mondiale de la santé, le respect des bonnes pratiques de laboratoire pharmaceutique ou BPL pharmaceutique est généralement limité à l’étape 2 du processus de développement des médicaments.
Définition des termes BPL
Installation d’essai – le laboratoire de recherche qui mène l’étude non clinique
Article d’essai ou élément d’essai – le produit étudié ou testé ; le sujet de l’étude
Système d’essai – ce sont :
- tout animal, plante ou micro-organisme auquel est appliqué l’article d’essai ou de contrôle.
- tout système biologique, chimique ou physique utilisé dans l’étude
Article de contrôle ou article de référence – un produit qui est.. :
- pas l’article d’essai, l’alimentation ou l’eau
- appliqué au système d’essai
- utilisé pour fournir une base de comparaison avec l’article d’essai
Lignes directrices sur les bonnes pratiques de laboratoire
Vous trouverez ci-dessous un guide des bonnes pratiques de laboratoire pour les différents éléments d’une étude :
Personnel
Avant le début de l’étude, le responsable de l’installation d’essai doit nommer un directeur d’étude qui sera responsable de la conduite générale de l’étude et de sa conformité aux BPL. L’installation d’essai doit également disposer d’une unité d’assurance qualité (UQA) distincte ou indépendante de l’organisation ou de la direction de l’installation d’essai.
Installations et équipements
L’installation d’essai doit prévoir une séparation des activités afin d’éviter les interférences et autres perturbations qui pourraient compromettre l’étude. Il doit y avoir des zones séparées pour :
- la réception et le stockage des articles d’essai et de contrôle
- le mélange des articles d’essai et de contrôle avec un support
- le stockage des mélanges d’articles d’essai et de contrôle
- le lieu des essais
Tous les équipements utilisés dans l’étude doivent être périodiquement étalonnés et entretenus. Les registres d’étalonnage et d’entretien doivent être conservés et mis à la disposition des opérateurs de l’équipement.
Caractérisation
Le personnel chargé de l’étude doit savoir ce qui suit sur chaque article d’essai et de contrôle :
- identité, pureté, composition et stabilité
- date de réception, date de péremption et instructions de stockage
- quantité reçue et quantité utilisée
Plan d’étude ou protocole
Le plan d’étude ou protocole est le document d’orientation principal pour la conduite de l’étude. Il décrit comment l’étude doit être réalisée et contient le calendrier général de l’étude et de ses différentes étapes. Elle comprend également la méthode et les matériaux utilisés dans l’étude.
Le protocole doit être approuvé, examiné et discuté avant que l’étude ne commence. Ce processus commence par la préparation du protocole par le directeur de l’étude et la discussion de son contenu avec le personnel et les autres membres de l’étude. Après discussion, le directeur de l’étude doit ensuite approuver le protocole en apposant sa signature datée.
Une fois que le protocole a été approuvé par le directeur de l’étude, il doit être examiné par l’UQA, qui évaluera sa conformité aux bonnes pratiques de laboratoire. À ce stade du processus, le personnel doit recevoir des instructions sur les tâches qui lui sont assignées dans le protocole, ainsi que leurs propres copies du protocole.
Procédures opérationnelles standard
Chacune des zones distinctes de l’installation d’essai doit disposer de procédures opérationelles standard (POD), en particulier pour les procédures de routine. Les modes opératoires normalisés doivent être approuvés par le responsable de l’installation d’essai et tout écart par rapport aux modes opératoires normalisés doit être autorisé par le directeur de l’étude.
Rapport final
Le rapport final est en définitive la responsabilité du directeur de l’étude, qui le prépare et l’approuve. Les principales caractéristiques du rapport final sont les suivantes :
- un compte rendu complet et précis du déroulement de l’étude
- tout écart par rapport à un plan d’action prévu (tel qu’une POS ou un protocole)
- l’interprétation scientifique des résultats et la discussion critique
- Déclaration de conformité aux BPL par le directeur de l’étude
Stockage des dossiers
Tout au long de l’étude, le directeur de l’étude sera chargé de veiller à ce que toutes les données relatives à l’étude soient saisies et incluses dans des dossiers conservés en toute sécurité. Ces dossiers et documents tels que le protocole, le rapport final et les procédures opérationnelles standard seront ensuite archivés à la fin de l’étude.
Seul le personnel autorisé par le responsable de l’installation d’essai peut accéder aux dossiers archivés. En outre, chaque cas d’accès, de retrait ou de retour de documents aux archives doit être enregistré. Il est également recommandé que les documents des archives soient indexés pour une recherche organisée.
Conservation des dossiers
La durée de conservation requise pour les dossiers archivés varie en fonction des réglementations nationales en matière de BPL. Pour les laboratoires de recherche aux États-Unis, utilisez les questions guides suivantes basées sur sous-partie J de 21 CFR Partie 58 (“Good Laboratory Practice for Nonclinical Laboratory Studies”) :
- Les résultats de l’étude ont-ils été soumis à la FDA ?
- Si OUI : L’étude soutient-elle une demande de drogue nouvelle de recherche (IND) ou une demande d’exemption de dispositif de recherche (IDE) ?
- Si oui : les enregistrements archivés doivent être conservés au moins 5 ans après la date à laquelle les résultats de l’étude ont été soumis à la FDA.
- Si non : les enregistrements archivés doivent être conservés au moins 2 ans après la date à laquelle la demande de permis de recherche ou de commercialisation a été approuvée par la FDA.
- Si NON : Les enregistrements archivés doivent être conservés au moins 2 ans après la date à laquelle l’étude a été achevée, terminée ou interrompue.
- Si OUI : L’étude soutient-elle une demande de drogue nouvelle de recherche (IND) ou une demande d’exemption de dispositif de recherche (IDE) ?
Exemples de bonnes pratiques de laboratoire
Vous trouverez ci-dessous des exemples généraux de bonnes pratiques de laboratoire :
- Portez en permanence des équipements de protection individuelle (EPI).
- Communiquer avec les autres membres du laboratoire de recherche.
- Participer à des formations de recyclage et à des exercices de sécurité.
- Soyez conscient de ce que vous faites à tout moment.
- Faites attention aux odeurs et aux substances non familières.
- Utilisez le bon équipement de laboratoire pour la tâche ou l’activité.
- Nettoyer, calibrer et entretenir régulièrement les équipements.
Exigences BPL
Réglementation des BPL aux ÉTATS-UNIS, ROYAUME-UNI et de l’UE ont des exigences BPL similaires puisqu’ils sont membres de l’Organisation de coopération et de développement économiques (OCDE). Cette organisation internationale a élaboré les principes de BPL utilisés dans de nombreux pays aujourd’hui.
Les 10 principes des bonnes pratiques de laboratoire sont les suivants :
- Organisation et personnel de l’installation d’essai
- Programme d’assurance qualité
- Installations
- Appareils, matériel, réactifs
- Systèmes d’essai
- Articles de test et de référence
- Procédures opérationnelles standard
- Performance de l’étude
- Communication des résultats de l’étude
- Stockage et conservation des dossiers et des documents
Comment SafetyCulture (anciennement iAuditor) peut vous aider à respecter la réglementation sur les BPL
SafetyCulture (iAuditor) est un organisme reconnu logiciel de gestion de la qualité que les responsables des installations d’essai, les directeurs d’études et AQ/CQ que les professionnels peuvent utiliser pour se conformer à la réglementation sur les BPL. SafetyCulture (iAuditor) peut être utilisé à chaque étape du programme de bonnes pratiques de laboratoire, de la préparation du plan d’étude ou du protocole à la soumission du rapport final pour examen par l’AQ.
Caractéristiques de SafetyCulture (iAuditor) pour le respect des réglementations BPL :
- Éditeur de modèles personnalisables :créez tout type de document ou de formulaire à l’aide de divers modèles les types d’articles et la logique intelligente. Enregistrez vos données en toute simplicité sur l’application mobile.
- Des inspections simples mais complètes : Effectuez des inspections basées sur les études, les installations et les processus à l’aide de n’importe quelle tablette ou appareil mobile. Ajouter des photos, des notes détaillées et attribuer des correctifs au personnel du laboratoire.
- Des rapports simplifiés et automatisés : Il suffit de compléter une inspection pour obtenir un rapport PDF et Web de l’inspection ou de l’audit. Envoyez immédiatement les rapports par courriel aux superviseurs ou enregistrez-les pour les consulter ultérieurement.
Disponible sous forme de logiciel web et d’application mobile, SafetyCulture (iAuditor) peut être téléchargé gratuitement et dispose d’un plan gratuit avec toutes les fonctionnalités mentionnées ci-dessus. Démarrez avec SafetyCulture (iAuditor) gratuitement !