¿Qué es el cGMP?
La Administración de Alimentos y Medicamentos de EE.UU. (FDA) define la normativa sobre buenas prácticas de fabricación (cGMP) como las directrices establecidas para garantizar el diseño, la supervisión y el control adecuados de los procesos, las instalaciones y las operaciones de fabricación. Aunque se utilizan a menudo en la industria farmacéutica, las normas cGMP también están presentes en otras industrias relacionadas con la medicina, como la biotecnología y la tecnología médica.
cGMP vs GMP
Las normas cGMP son muy similares a las Buenas Prácticas de Fabricación (GMP) en el sentido de que ambas buscan promover la seguridad y la calidad. En algunos casos, también se utilizan indistintamente, ya que ambos siguen las 5P:
- Gente
- Productos
- Locales
- Procedimientos
- Procesos
Sin embargo, hay pequeñas diferencias a tener en cuenta. Las normas GMP se han establecido y aplicado durante mucho tiempo a todas las industrias y tareas, y su cumplimiento garantiza que todas las partes del proceso -desde la creación y el mantenimiento de registros hasta el envasado- se realicen de forma correcta, precisa y segura. Mientras tanto, las GMPc pueden modificarse continuamente en función de las circunstancias y la naturaleza del trabajo. Esto se debe a que las GMPc suelen crearse teniendo en cuenta las últimas tecnologías e innovaciones, que también están sujetas a diferentes cambios, actualizaciones y desarrollos que se producen con el tiempo.
La diferencia entre ellos es también lo que justifica la “c” pequeña de cGMP. La “c” se añade para mostrar que no sólo el producto creado siguió las directrices de las GMP, sino que también se consideraron y evaluaron cuidadosamente los procesos nuevos y más actuales.
Otra diferencia entre las cGMP y las GMP es el coste. Dado que las GMPc tienen en cuenta las nuevas tecnologías, puede resultar más caro obtener la certificación, ya que se requieren más pruebas y evaluaciones. Esto es especialmente cierto en el caso de los productos farmacéuticos, ya que tendrían que someterse a pruebas más rigurosas para garantizar su seguridad.
Propósito de tener cGMP
Contar con las directrices de las GMPc es tan importante como disponer de las GMP estándar. Aunque se pueden seguir con dedicación las BPF y otros procedimientos de ensayo, hay que tener en cuenta las tendencias y tecnologías actuales, especialmente en los campos relacionados con la medicina.
Los productos de la industria farmacéutica suelen requerir muchas rondas de pruebas, pero éstas no siempre son suficientes. Algunas cosas pueden tener problemas que podrían haberse detectado antes durante la fase de fabricación o entre las etapas. Aquí es donde entran en juego las cGMP. Las GMPC no sólo tienen en cuenta las tecnologías utilizadas tanto en la producción como en las pruebas, sino que las normas GMPC también tienen en cuenta las condiciones de trabajo de los empleados.
Las normas cGMP exigen que los empleados conozcan todos los procesos de producción y las normas de calidad, así como el manejo de las máquinas con las que trabajan a diario. Las diferentes máquinas y formas de tecnología utilizadas y las personas que intervienen en su funcionamiento se incluyen en la gestión de la calidad total para que las empresas y los organismos reguladores de las GMP tengan una idea de si los productos creados son seguros para el consumo, incluso antes de que se realicen las pruebas. De este modo, la calidad se garantiza y se mejora en cada paso del proceso, y no sólo al final.
cGMP y GMP frente a GLP
cGMP y GMP vs. GLP | SafetyCulture
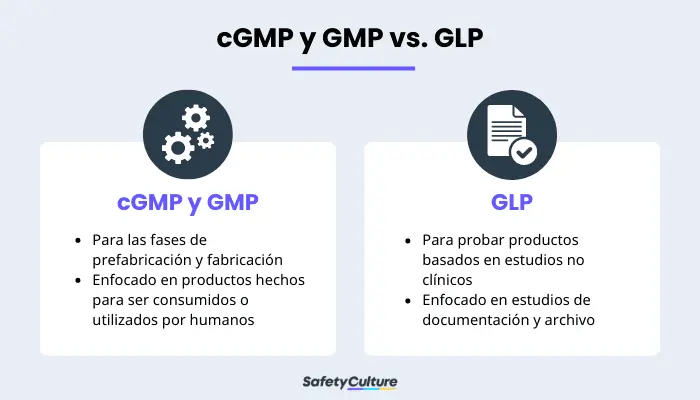
Las normas cGMP y GMP se confunden a veces con las Buenas Prácticas de Laboratorio (BPL) debido a que ambas son necesarias para la industria farmacéutica. Sin embargo, es importante distinguir sus diferencias.
Las normas cGMP y GMP se refieren a las fases de pre-fabricación y fabricación de un producto. Aunque también existen reglamentos para las pruebas, las GGMP y las GMP se centran más en los procesos. Por otro lado, las normas BPL se refieren principalmente a los ensayos de productos terminados. En la industria farmacéutica, es importante seguir ambas cosas antes de lanzar un producto al mercado público.
Otra diferencia clave es el lugar donde se utilizan. Las BPFc y las BPF pueden aplicarse a otros campos además de la medicina, siempre que los productos que se produzcan vayan a ser utilizados por los seres humanos. Las BPL, por su parte, se centran en las pruebas generales de medicamentos basadas en estudios de laboratorio no clínicos. Otros aspectos en los que se centran las BPL son la documentación y el archivo de los estudios y las teorías llevados a cabo en diferentes entornos de laboratorio.
Estar al día con las normas cGMP
En la actualidad, si uno quiere una certificación formal de las GMP, tiene que hablar con acreditadores externos reconocidos. La propia FDA no emite certificados tanto para cGMP como para GMP.
En cualquier caso, la FDA exige que todos sigan las directrices de las GMP. En la página de documentos orientativos de la FDA se pueden encontrar las normativas de las GMP de los distintos productos e industrias para que todo el mundo pueda consultarlas.
Los productos que no siguen las normas cGMP no se consideran necesariamente inseguros, sino que pueden denominarse “adulterados” según la ley. Por ejemplo, en lugar de decir a la gente que deje de consumir productos adulterados, la FDA aconseja a los pacientes que están siguiendo su terapia farmacológica que no la interrumpan, ya que hacerlo podría causarles daños. En algunos casos, la FDA puede pedir a las empresas que retiren sus productos, o incluso que dejen de distribuirlos por completo.
Una buena forma de mantenerse al día con las normas cGMP es utilizar listas de comprobación. Las listas de comprobación digitales, en concreto, pueden ser de gran ayuda para hacer un seguimiento del cumplimiento de las normas de la FDA desde cualquier dispositivo y lugar. Estas listas de comprobación también pueden utilizarse para anotar los documentos que hay que presentar para la acreditación.
Las listas de comprobación digitales también pueden ayudar a auditar los procesos de fabricación actuales, con o sin solicitud de certificación. Disponer de listas de comprobación para las auditorías internas puede ser de gran ayuda para mejorar los procesos existentes, identificar los problemas a tiempo y crear planes de contingencia.
SafetyCulture (iAuditor) para el control de calidad
Para mantenerse al día con las normativas y los requisitos de las GMP, así como con la garantía de calidad, considere la posibilidad de utilizar una aplicación digital de listas de comprobación. SafetyCulture (iAuditor) es una aplicación de inspección que puede utilizar para crear y utilizar listas de comprobación. También tiene la opción de utilizar plantillas prefabricadas de la Biblioteca Pública y editarlas a su gusto. También puede utilizar sus listas de control existentes en Word, Excel y PDF en la aplicación.
Con la lista de comprobación digital (iAuditor), puede:
- Asignar puntuaciones y marcar las cosas como “fallidas” en caso de que no se ajusten a las normas cGMP
- Almacene las plantillas creadas y las inspecciones terminadas en un solo lugar
- Informar a los demás de los problemas, desviaciones u otros casos de incumplimiento planteando problemas, asignando acciones y avisando a los demás.
- Programar las inspecciones
- Generar informes analíticos basados en inspecciones anteriores para ayudarle a abordar mejor cualquier problema
- Exportación de informes de inspección como archivos Word o PDF
Pruebe hoy mismo SafetyCulture (iAuditor) de forma gratuita.



