Guía de Buenas Prácticas de Laboratorio (BPL)
Aprenda que son las Buenas Prácticas de Laboratorio, cuáles son los ejemplos de Buenas Prácticas de Laboratorio, qué son los principios de las Buenas Prácticas de Laboratorio, qué son las BPL y las BPF, y cuáles son los requisitos de las BPL

Publicación 19 Aug 2025
Artículo de
9 min de lectura
¿Qué son las Buenas Prácticas de Laboratorio?
Las Buenas Prácticas de Laboratorio (BPL) son un sistema de calidad que abarca el proceso organizativo y las condiciones en las que se planifican, realizan, supervisan, registran, notifican y archivan los estudios de laboratorio no clínicos. Las BPL garantizan la calidad e integridad de los datos de las pruebas de seguridad que se presentan al gobierno para la concesión de permisos de investigación.
BPM – Buenas Prácticas de Laboratorio
La diferencia entre GMP y las BPL son su ámbito de aplicación. Las Buenas Prácticas de Fabricación se aplican a todo el proceso de fabricación del medicamento, mientras que las Buenas Prácticas de Laboratorio se aplican únicamente a la fase de pruebas de seguridad. Tanto las BPF como las BPL son aplicadas por la Administración de Alimentos y Medicamentos (FDA) en Estados Unidos.
¿Necesita cumplir las BPL?
A continuación se muestra una tablabasada en la guía de la FDA para ayudar a los laboratorios de investigación a determinar si un estudio o actividad específica debe cumplir con las Buenas Prácticas de Laboratorio:
Se requiere el cumplimiento de las BPL | No se requiere el cumplimiento de las BPL |
estudios sobre productos zoosanitarios: estudios de sobredosis en las especies de destino, estudios de seguridad animal en las especies de destino, estudios de acumulación y agotamiento de residuos en los tejidos y estudios de irritación de la ubre cuando los estudios de seguridad realizados para determinar las características potenciales de abuso de drogas de un artículo de prueba deben presentarse a la FDA como parte de una solicitud de permiso de investigación o comercialización procedimientos químicos utilizados para caracterizar el artículo de prueba, paradeterminar la estabilidad del artículo de prueba y sus mezclas, y para determinar la homogeneidad y la concentración de las mezclas del artículo de prueba | ensayos de validación realizados para confirmar los métodos analíticos utilizados para determinar la concentración del artículo de ensayo en los tejidos animales y las formas farmacéuticas estudios de seguridad de los productos cosméticos evaluación organoléptica de los alimentos procesados trabajo realizado para desarrollar métodos químicos de análisis o para establecer las especificaciones de un artículo de prueba procedimientos químicos utilizados para analizar las muestras (por ejemplo, química clínica, análisis de orina) |
Las BPL tampoco son necesarias durante las primeras fases de desarrollo, como el descubrimiento, el cribado, la investigación básica y la evaluación del concepto. Según laOrganización Mundial de la SaludEl cumplimiento de las BPL suele limitarse a la segunda fase del proceso de desarrollo del medicamento.
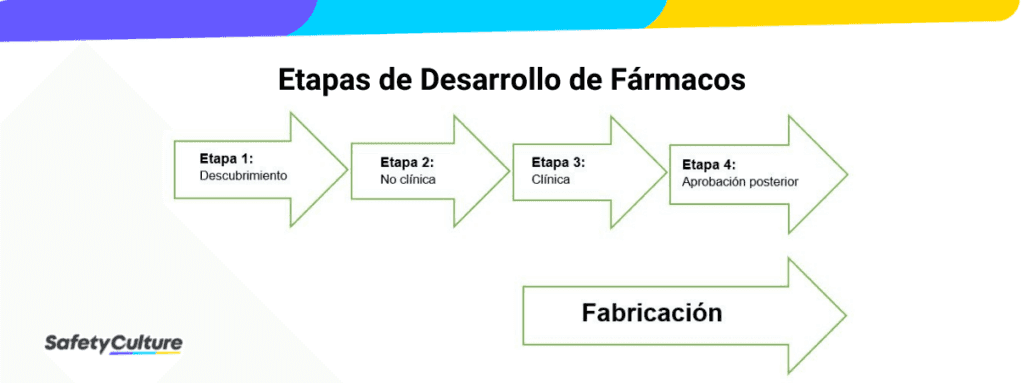
Fuente de la imagen: OMS TDR GLP
Definición de términos de BPL
Instalación de pruebas o laboratorio de pruebas – el laboratorio de investigación que realiza el estudio no clínico Artículo de prueba o elemento de prueba – el producto que se estudia o prueba; el objeto del estudio Sistema de pruebas – son:
cualquier animal, planta o microorganismo al que se aplique el artículo de prueba o de control
cualquier sistema biológico, químico o físico utilizado en el estudio
Artículo de control o elemento de referencia : un producto que es:
no el artículo de prueba, el alimento o el agua
aplicada al sistema de pruebas
se utiliza para proporcionar una base de comparación con el artículo de prueba
Directrices de buenas prácticas de laboratorio
A continuación se exponen las directrices de buenas prácticas de laboratorio para los distintos elementos de un estudio:
Personal
Antes de que comience el estudio, el director del centro de pruebas debe nombrar a un director del estudio que será responsable de la realización general del estudio y de su cumplimiento de las BPL. El centro de pruebas también debe tener una Unidad de Garantía de Calidad (UGC) que esté separada o sea independiente de la organización o la dirección del centro de pruebas.
Instalaciones y equipos
Las instalaciones de ensayo deben proporcionar una separación de actividades para evitar interferencias y otras perturbaciones que puedan comprometer el estudio. Debe haber áreas separadas para:
la recepción y el almacenamiento de los artículos de prueba y de control
la mezcla de los artículos de prueba y de control con un soporte
el almacenamiento de las mezclas de artículos de prueba y de control
el alojamiento de los sistemas de prueba
Todos los equipos utilizados en el estudio deben ser calibrados y mantenidos periódicamente. Los registros de calibración de calibración y mantenimiento y ponerlos a disposición de los operadores de los equipos
Caracterización
El personal que realice el estudio debe saber lo siguiente sobre cada artículo de prueba y de control:
identidad, pureza, composición y estabilidad
fecha de recepción, fecha de caducidad e instrucciones de almacenamiento
cantidad recibida y cantidad utilizada
Plan o protocolo de estudio
El plan o protocolo del estudio es el documento guía principal para la realización del estudio. En él se expone cómo debe realizarse el estudio y se incluye el calendario general del mismo y de sus distintas fases. También incluye el método y los materiales utilizados en el estudio.
El protocolo debe ser aprobado, revisado y discutido antes de que comience el estudio. Este proceso se inicia con la preparación del protocolo por parte del director del estudio y la discusión de su contenido con el personal y el resto del personal del estudio. Tras el debate, el director del estudio debe aprobar el protocolo estampando su firma con fecha.
Una vez que el protocolo ha sido aprobado por el director del estudio, debe ser revisado por la UGC, que evaluará su conformidad con las buenas prácticas de laboratorio. En este punto del proceso, el personal debe ser instruido sobre las funciones que se le asignan en el protocolo, así como recibir sus propias copias del mismo.
Procedimientos operativos estándar
Cada una de las áreas separadas de la instalación de pruebas debe tener procedimientos operativos estándar (SOP), especialmente para los procedimientos de rutina. Los PNT deben ser aprobados por el director del centro de pruebas y cualquier desviación de los PNT debe ser autorizada por el director del estudio.
Informe final
El informe final es, en última instancia, responsabilidad del director del estudio, que prepara y aprueba el informe. Las principales características del informe final son:
una relación completa y precisa de la realización del estudio
cualquier desviación de un curso de acción previsto (como un POE o un protocolo)
interpretación científica de los resultados y discusión crítica
Declaración de cumplimiento de las BPL por parte del director del estudio
Almacenamiento de registros
A lo largo del curso del estudio, el director del estudio será responsable de garantizar que todos los datos relativos al estudio se capturen y se incluyan en registros que se almacenen de forma segura. Estos registros y documentos, como el protocolo, el informe final y los procedimientos operativos estándar, se archivarán al final del estudio.
Sólo el personal autorizado por el director del centro de pruebas puede acceder a los registros archivados. Además, cada vez que se acceda a los registros, se retiren de ellos o se devuelvan a los archivos debe registrarse. También se recomienda indexar los registros de los archivos para poder recuperarlos de forma organizada.
Conservación de registros
El período de conservación requerido para los registros archivados varía en función de la normativa nacional sobre BPL. Para los laboratorios de investigación en los Estados Unidos, utilice las siguientes preguntas guía basadas enSubparte Jde21 CFR Parte 58(«Buenas prácticas de laboratorio para estudios de laboratorio no clínicos»):
¿Se presentaron los resultados del estudio a la FDA?
Si la respuesta es afirmativa: ¿el estudio apoya una solicitud de nuevo fármaco en investigación (IND) o una solicitud de exención para dispositivos en investigación (IDE)?
En caso afirmativo: los registros archivados deben conservarse al menos 5 años después de la fecha de presentación de los resultados del estudio a la FDA.
Si no: Los registros archivados deben conservarse al menos 2 años después de la fecha en que la FDA aprobó la solicitud de permiso de investigación o comercialización.
Si la respuesta es NO: Los registros archivados deben conservarse al menos 2 años después de la fecha de finalización, terminación o interrupción del estudio.
Ejemplos de buenas prácticas de laboratorio
A continuación se presentan ejemplos generales de buenas prácticas de laboratorio:
Llevar siempre el equipo de protección personal (EPP).
Comunicarse con otros miembros del laboratorio de investigación.
Participar en cursos de actualización y ejercicios de seguridad.
Sé consciente de lo que estás haciendo en todo momento.
Preste atención a los olores y sustancias desconocidas.
Utilizar el equipo de laboratorio adecuado para la tarea o actividad.
Limpiar, calibrar y mantener regularmente el equipo.
Requisitos de las BPL
Las normas BPL en losEE.UU.,REINO UNIDOyUEtienen requisitos de BPL similares, ya que sonmiembrosde la Organización para la Cooperación y el Desarrollo Económico (OCDE). Esta organización internacional desarrolló elPrincipios de BPLutilizados hoy en día en muchos países.
Las 10 Buenas Prácticas de Laboratorio son
Organización y personal del centro de pruebas
Programa de garantía de calidad
Instalaciones
Aparatos, material, reactivos
Sistemas de prueba
Artículos de prueba y referencia
Procedimientos operativos estándar
Realización del estudio
Comunicación de los resultados del estudio
Almacenamiento y conservación de registros y materiales
Cómo puede ayudar SafetyCulture (antes iAuditor) en el cumplimiento de las normas BPL
SafetyCulture es un reconocidosoftware de gestión de la calidadque los gestores de las instalaciones de pruebas, los directores de estudios y QA/QC profesionales pueden utilizar para el cumplimiento de las normas de Buenas Prácticas de laboratorio.SafetyCulture puede utilizarse en cada paso del programa de buenas prácticas de laboratorio, desde la preparación del plan o protocolo del estudio hasta la presentación del informe final para la revisión del control de calidad.
Características deSafetyCulture (iAuditor) para el cumplimiento de las normas BPL:
Editor de plantillas personalizable: Haga cualquier tipo de documento o formulario con varias plantillas tipos de artículos y lógica inteligente. Registre los datos cómodamente en la aplicación móvil.
Inspecciones fáciles y completas: Realice inspecciones basadas en estudios, instalaciones y procesos utilizando cualquier tableta o dispositivo móvil. Añade fotos, notas detalladas y asigna correctivos acciones al personal del laboratorio.
Informes elegantes y automatizados: Basta con completar una inspección para obtener un informe en PDF y en la web informe de la inspección o auditoría. Envíe inmediatamente los informes por correo electrónico a los supervisores o guárdelos para futuras consultas.
Disponible como software basado en la web y como aplicación móvil, SafetyCulture se puede descargar gratuitamente y tiene un plan gratuito con todas las características mencionadas anteriormente.Comience a utilizar SafetyCulture de forma gratuita.
Plantillas de buenas prácticas de laboratorio
Plantilla de protocolo de buenas prácticas de laboratorio (BPL)
Los directores de estudios designados por los gestores de las instalaciones de ensayo para los estudios de laboratorio no clínicos pueden utilizar esta plantilla para cumplir con el plan de estudio o el requisito de protocolo de las normas de Buenas Prácticas de Laboratorio (BPL). Basado en ambosLa regulación de la FDAyprincipios de la OCDEEsta plantilla puede utilizarse para lo siguiente
Identificar el elemento de prueba, el elemento de referencia y el sistema de prueba
Añadir la justificación de la selección del sistema de pruebas
Determinar los niveles de dosis, la vía de dosificación y la duración
Describa el procedimiento cronológico del estudio
Enumerar los análisis y las mediciones que deben realizarse
Plantilla de informe de buenas prácticas de laboratorio (BPL)
Los directores de estudios designados por los gestores de las instalaciones de ensayo para los estudios de laboratorio no clínicos pueden utilizar esta plantilla para cumplir con el requisito del informe final de las normas de buenas prácticas de laboratorio (BPL). Basado en ambosLa regulación de la FDAyprincipios de la OCDEEsta plantilla puede utilizarse para lo siguiente
Anotar los cambios y desviaciones del plan o protocolo del estudio
Resumir, presentar, evaluar y discutir los resultados del estudio
Describa las circunstancias que pueden haber afectado a la calidad o integridad de los datos
Identificar los lugares en los que se almacenarán el plan o el protocolo del estudio, las muestras de los elementos de prueba y de referencia, los especímenes, los datos brutos y el informe final
Añadir la declaración de conformidad con las BPL y la declaración de garantía de calidad
En este artículo
- ¿Qué son las Buenas Prácticas de Laboratorio?
- BPM – Buenas Prácticas de Laboratorio
- ¿Necesita cumplir las BPL?
- Definición de términos de BPL
- Directrices de buenas prácticas de laboratorio
- Ejemplos de buenas prácticas de laboratorio
- Requisitos de las BPL
- Cómo puede ayudar SafetyCulture (antes iAuditor) en el cumplimiento de las normas BPL
- Plantillas de buenas prácticas de laboratorio
Artículos relacionados
Calidad
Gestión de Calidad

Una guía para conseguir cero defectos
Conozca la filosofía de los cero defectos, lo que significa y cómo lograr los cero defectos en la gestión de la calidad.
Calidad
Gestión de Calidad

Acciones correctivas y preventivas (CAPA)
Aprenda más sobre la acción preventiva y correctiva, su importancia, la diferencia entre ambas y las herramientas CAPA para el trabajo.
Calidad
Gestión de Calidad
Herramientas de gestión de la calidad
Todo sobre las herramientas de gestión de calidad que pueden ayudarle a ofrecer productos y servicios de alta calidad. Empiece con iAuditor.