Qu’est-ce qu’un processus de validation ?
La processus de validation est une procédure étape par étape conçue pour garantir qu’une industrie peut produire de façon constante des produits de qualité. Il est effectuée par une équipe de validation dirigée par le responsable de l’assurance qualité des fabricants de l’industrie pharmaceutique. En général, le processus de validation est effectué avant la mise sur le marché d’un nouveau produit, lors de l’application d’un changement sur un produit existant, et pour vérifier périodiquement le processus. Établi dès le départ, un protocole doit préciser la manière dont le processus de validation sera mené, notamment les paramètres à surveiller, les échantillons à prélever et les résultats à accepter.
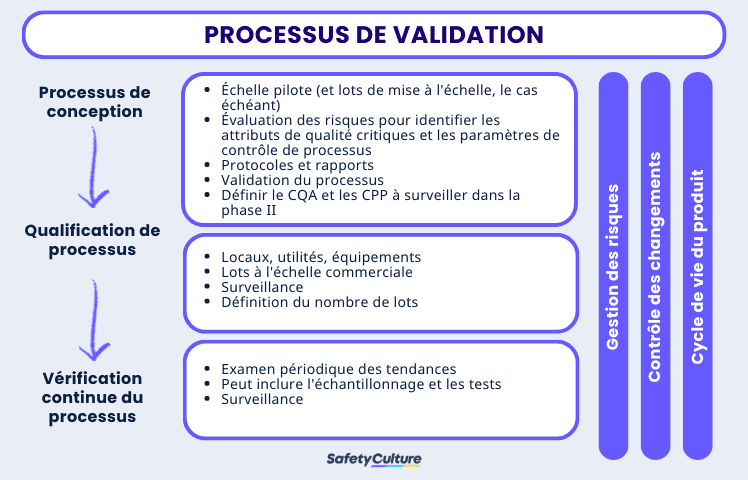
Phases de la validation des processus | SafetyCulture
Guide de la validation des processus : ANSES
L’Agence nationale de sécurité sanitaire de l’alimentation (ANSES) évalue la sécurité sanitaire des aliments pour les humains et les animaux en France.
3 étapes des processus de validation
Pour chaque demande d’autorisation de mise sur le marché (AMM) d’un produit, l’Anses évalue l’efficacité et les risques éventuels pour la santé de l’Homme, des animaux et pour l’environnement. Sur la base de cette évaluation scientifique, elle délivre ou non des AMM qui en fixent les conditions d’emploi et de protection des utilisateurs. Toutes les décisions sont publiées et accessibles sur le site internet de l’Anses, de même que les conclusions de l’évaluation.
Étape 1 : Conception du processus
Au cours de cette étape, le processus industriel est défini de manière à pouvoir reproduire la livraison d’un médicament qui répond à des spécifications et à des attributs de qualité prédéterminés. Pour y parvenir, l’équipe de validation doit avoir une bonne compréhension du fonctionnement réel du processus. Considérez les sources et méthodes suivantes pour recueillir des informations sur les processus :
- Activités de développement de produits
- Fonctionnalité et limites des équipements de production
- Contributions prévues à la variabilité
- Études de plans d’expérience
- Outils d’analyse des risques
- Expériences ou démonstrations en laboratoire ou à l’échelle pilote
- Simulations sur ordinateur ou virtuelles
Cette étape implique également le contrôle du processus, la planification de stratégies visant à réduire la variation des intrants et/ou à l’ajuster. Les contrôles consistent généralement en une analyse des matériaux et une surveillance des équipements aux points de traitement importants. Dans certains cas, l’utilisation de la technologie d’analyse des processus (PAT) peuvent être nécessaires.
Étape 2 : Qualification du processus
L’étape de qualification du processus implique l’évaluation de la conception du processus afin de déterminer s’il est efficace pour une production de qualité. Premièrement, l’installation doit être conçue conformément aux exigences des bonnes pratiques de fabrication actuelles (BPF). Ensuite, la qualification des services publics et des équipements d’équipements, par exemple en s’assurant qu’ils sont construits et installés installés en conformité avec les spécifications de conception. Enfin, qualification de la performance du processus doit être exécutée par le biais d’un protocole et documentée dans un rapport :
- Introduction, objectifs et portée
- la production, l’assurance qualité et le contrôle de la qualité. Responsabilités et conditions préalables (par exemple, registres de fabrication)
- Plan d’étude de validation du processus basé sur la gestion du risque qualité (QRM)
- Équipe de validation (recherche et développement, ingénierie, production, AQ et CQ)
- Détails du produit et considérations de conception
- Liste des matériaux, des vendeurs et de la formule maîtresse
- Liste des équipements et organigramme du processus
- Bref processus de fabrication et évaluation des paramètres critiques du processus (CPP)
- Test en cours de fabrication et spécifications ou attributs critiques de qualité (CQA)
- Échantillonnage, plan d’essai, critères d’acceptation et limites.
- Détails du rendement (un minimum de trois lots consécutifs)
- Validation de la méthode analytique
- Spécification du produit fini
- Examen des demandes hors spécification (OOS), des déviations et du contrôle des changements (CC).
- Critères de revalidation
- Examen de l’action de suivi (le cas échéant)
- Résumé et conclusion
Étape 3 : Vérification continue du processus
Après la conception et la qualification du processus, la troisième étape de la validation du processus consiste à mettre en place des systèmes permettant de garantir en permanence que le processus validé reste dans cet état pendant la production de routine. La vérification continue du processus intègre souvent l’utilisation du contrôle statistique du processus (SPC), la surveillance et l’échantillonnage continus des paramètres du processus et des attributs de qualité, ainsi que la maintenance programmée de l’installation, des services publics et de l’équipement. Il est essentiel pour les bonnes pratiques de documentation à utiliser tout au long du processus de validation.
4 types de processus de validation
Le processus de validation est souvent classé en fonction du moment où il est effectué par rapport au calendrier de production. Sur la base de cette description, il existe 4 types de processus : la validation prospective, la validation rétrospective, la validation simultanée et la revalidation.
Type 1 : Validation prospective
Elle est mise en œuvre lorsqu’un produit est fabriqué avec une nouvelle formule ou dans une nouvelle installation. Également connue sous le nom de validation avant commercialisation, la validation prospective est généralement effectuée avant de commencer la production de routine. Elle est également considérée comme le type de validation fondamental car elle constitue le point de départ de tout produit qui sera lancé dans de nouvelles conditions.
Type 2 : Validation rétrospective
Elle n’est effectuée que lorsque le processus industriel n’a pas fait l’objet d’une validation formelle documentée. La validation rétrospective s’effectue normalement par l’utilisation de données historiques et l’analyse des tendances afin de prouver que le processus se trouve dans l’état dans lequel il est censé se trouver. Dans la plupart des cas, ce n’est plus une approche acceptable de la validation des processus, car tout produit devrait déjà avoir été validé avant sa distribution commerciale.
Type 3 : Validation simultanée
Elle est effectuée au cours de la production pharmaceutique régulière pour démontrer que le processus fonctionne au niveau qu’il devrait atteindre au cours de son exécution réelle.
Récemment, une inspection de la FDA a révélé qu’un fabricant basé aux États-Unis produisait des médicaments frelatés. Pour corriger leurs violations, la société pharmaceutique a répondu en ayant l’intention de mettre en œuvre la validation concomitante. Cependant, l’USFDA a prévenu contre elle parce qu’ils n’ont pas réussi à montrer une compréhension claire des sources de variabilité dans leurs processus industriels. L’agence leur a demandé de se conformer à des réglementations BPF spécifiques, y compris la validation adéquate des processus industriels.
Type 4 : Revalidation
La revalidation est plus largement utilisée pour les dispositifs médicaux que pour les médicaments. Elle est exécutée lorsque la validation prospective arrive à la conclusion que le processus industriel est incapable de produire le produit de manière constante. En outre, un critère de revalidation peut être indiqué dans le protocole de validation original. Le processus de revalidation peut ne pas être aussi complet que la validation initiale, surtout si la situation ne nécessite que la répétition de certains aspects.
Exemples
Un processus validé permet non seulement de réduire la probabilité de défaillance des lots, mais aussi d’augmenter la productivité de l’installation industrielle en minimisant les reprises et les rejets. Parmi les exemples de procédés qui doivent être validés figurent la stérilisation, le remplissage aseptique, le traitement thermique, le placage et le moulage par injection de plastique. Un plan directeur de validation typique pour les processus biotechnologiques contient :
- Approbation du plan directeur
- Maintenance du plan directeur de validation (révisions du document et historique des révisions)
- Définitions
- Acronymes
- Objectif du plan directeur de validation
- Portée du plan directeur de validation
- Stratégie de validation du processus (introduction, qualification du support, paramètres critiques du processus, nombre d’essais à effectuer, fiche de non-conformité, etc)
- Documentation de la validation du processus (protocoles, rapports, documents de stratégie/évaluations, et conservation des dossiers)
- Rôles et responsabilités (Services techniques, Opérations, Ingénierie, Laboratoire de contrôle de la qualité, Assurance de la qualité et Services externes)
- Description du processus
- Description de la validation du processus (documenter et soutenir la qualification des stratégies de maintien et de mélange)
- Maintenance de l’état validé et qualifié (Calendrier, maintenance préventive et étalonnage, revue annuelle des produits, contrôle des changements, revue périodique et vérification continue des processus).
Établir des preuves documentées de processus contrôlés
La documentation est un élément clé de la réussite de la validation des processus. SafetyCulture (anciennement iAuditor) est un outil de collecte et d’évaluation des données conçu pour permettre aux équipes de validation de documenter plus facilement les informations relatives au processus, d’exécuter le protocole de validation et de tenir à jour tous les enregistrements. Avec SafetyCulture (iAuditor), les fabricants peuvent fournir des preuves de leur capacité à contrôler les processus de l’industrie pharmaceutique :
- Utilisez les modèles de rapports de validation de processus sur appareils mobiles tels que les smartphones, les tablettes et les iPads, même hors connexion.
- Capturez des preuves photographiques des différentes étapes de la validation du processus et annotez les images pour une meilleure référence visuelle.
- Créez instantanément des rapports de validation partageables et d’aspect professionnel, avec toutes les pièces jointes nécessaires, en un simple toucher du doigt.
- Classez automatiquement les documents dans un stockage en ligne sécurisé, qui peuvent également être téléchargés au format PDF et envoyés par courrier électronique au personnel désigné.
- Ajoutez jusqu’à 10 employés ou membres de l’équipe de validation en utilisant un compte SafetyCulture (iAuditor) gratuit.


