Qu’est-ce que la certification ISO 13485 ?
Une certification ISO 13485 est un moyen de démontrer la conformité d’une organisation à la norme ISO 13485 créée par l’Organisation internationale de normalisation (ISO) pour l’industrie de la industrie dispositifs médicaux. Sa version actuelle est la norme ISO 13485:2016, dont la validité est généralement de 3 ans, comme pour les autres certifications ISO.
Pourquoi la certification ISO est-elle importante pour un fabricant de dispositifs médicaux ?
La conformité à la norme ISO 13485 aide les organisations à établir un système de management de la qualité (SGQ) qui leur permettra d’élaborer et de maintenir des méthodes et des processus efficaces pour la industrie dispositifs médicaux. En outre, l’alignement de vos normes de qualité sur les directives internationalement reconnues permet à votre organisation de garantir des systèmes de premier ordre et rationalisés pour la conception, la production et la distribution de dispositifs médicaux sûrs et performants.
Il convient également de noter que de nombreuses normes ISO sont reconnues par des organismes de réglementation tels que la Food and Drug Administration (FDA) américaine et qu’elles sont calquées sur des normes similaires d’autres parties du monde, comme l’Union européenne (UE). Par conséquent, être certifié ISO signifie que vous disposez d’un avantage concurrentiel non seulement parmi les organisations similaires mais aussi parmi les fabricants internationaux de dispositifs médicaux.
En résumé, les facteurs suivants renforcent l’importance d’avoir une certification ISO 13485 :
- Processus de fabrication de haute qualité
- Engagement en faveur de l’amélioration continue
- Crédibilité
- Avantage concurrentiel parmi les pairs
- Respect des exigences réglementaires
Quels sont les avantages de la certification ISO 13485 ?
En étroite relation avec son importance, le fait d’être certifié pour la norme ISO 13485 procure aux organisations les avantages majeurs suivants :
- Réduction du besoin de répéter les processus
- Gestion rationalisée de la qualité
- Reconnaissance de la conformité aux normes industrielles internationales.
- Une rentabilité accrue
- Satisfaction continue du client
Processus de certification ISO 13485
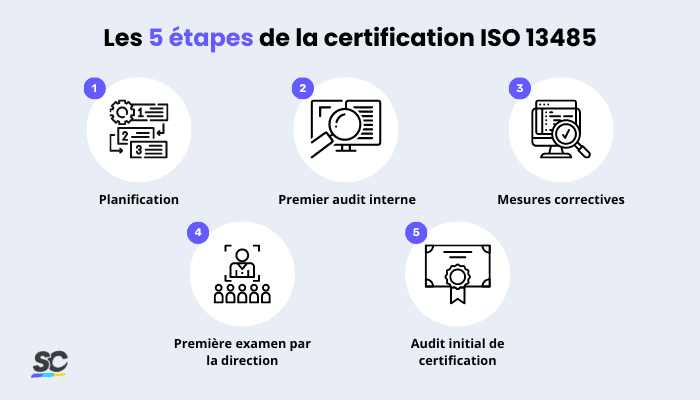
Processus de certification ISO 13485 | SafetyCulture
Selon l’entreprise ou l’organisation, certaines des exigences initiales et des étapes à suivre pour obtenir une certification ISO 13485 peuvent varier. Néanmoins, les étapes suivantes devraient vous permettre de démarrer :
1. Planification
C’est là que votre organisation planifie la manière d’établir votre SMQ et de l’aligner sur les exigences de planification de la qualité de la norme. Il s’agit notamment de créer un manuel de qualité et de fournir une méthode optimisée de documentation des plans de qualité lors de la mise en œuvre de modifications pertinentes de votre SMQ.
En outre, les tâches suivantes doivent également être accomplies :
- Obtenez une copie de la norme ISO 13485 et d’autres documents connexes.
- Déterminer et établir les processus pertinents.
- Affectez des auditeurs internes et des équipes à ces processus.
- Établissez un calendrier, créez des flux de travail et définissez des directives pour chaque processus.
- Effectuez des analyses des lacunes pour chaque tâche ou processus.
- Fournir une formation à la certification ISO 13485 pour les propriétaires de processus.
- Améliorer et finaliser les processus.
- Normaliser les processus et documenter les enregistrements nécessaires.
2. Premier audit interne
Le premier audit interne permet à votre organisation de vérifier l’efficacité de votre SMQ avant même que l’organisme de certification tiers n’effectue l’audit initial. De cette façon, vous pouvez identifier les non-conformités et leurs causes profondes dès le départ et concevoir les actions nécessaires pour les atténuer et les traiter.
3. Actions correctives
Sur la base du rapport d’audit interne, vous pouvez maintenant déterminer s’il y a des problèmes à éliminer ou des domaines à améliorer. C’est ici que vous lancez un processus d’action corrective et préventive (CAPA). Une telle procédure de gestion de la qualité vous aidera à définir les actions nécessaires et les améliorations à apporter aux processus par toutes les personnes impliquées dans ces domaines.
4. Premier examen par la direction
Juste avant de demander un audit par une tierce partie, il est essentiel que votre direction passe en revue les objectifs de qualité de votre organisation. Après l’examen, la direction finalise une liste de points d’action trouvés dans les audits internes et d’améliorations à mettre en œuvre. Cette liste peut ensuite être utilisée comme document d’orientation pour la prochaine revue de direction avant de demander la certification.
5. Audit initial de certification ISO 13485
Dans cette étape, commencez par rechercher et choisir l’organisme tiers qui effectuera la certification parmi les organismes de certification ISO 13485 reconnus. Ensuite, la demande globale de certification commence – il s’agit de remplir le formulaire, de le réviser et de le soumettre à l’organisme de certification. Dans la plupart des cas, c’est également là que se fait la signature du contrat.
En outre, cette étape comporte deux volets :
- Étape 1 (étude de la documentation) – L’auditeur tiers se concentre sur la vérification de la manière dont une organisation documente ses systèmes. Par conséquent, le processus CAPA, le calendrier de révision de la direction et le SMQ global doivent être en place. Voici quelques-uns des documents que vous devez préparer pour la première étape :
- Manuel de qualité
- Organigramme
- Processus et calendrier d’audit interne
- Protocoles et journal CAPA
- Processus d’examen de la gestion et conclusions
- Étape 2 (audit primaire) – C’est là que vous vous assurez que le reste des exigences de la certification ISO 13485 sont remplies dans votre organisation. L’auditeur de certification vérifie maintenant si toutes les exigences réglementaires ont été respectées, en particulier celles qui sont reconnues sur les marchés internationaux. En outre, l’auditeur évalue l’efficacité de votre système qualité global en échantillonnant les enregistrements de chacun des processus mis en œuvre par votre organisation. Enfin, la deuxième étape de la certification initiale vous permettra également de déterminer le calendrier des audits de surveillance (généralement effectués chaque année) et de la réévaluation.
FAQ
Bien que la certification ISO 13485 ne soit pas obligatoire pour tous les fabricants de dispositifs médicaux, il est essentiel d’en avoir une pour les aider à prouver leur efficacité et leur engagement en matière de sécurité aux acheteurs. La certification s’applique donc aux organisations, quels que soient leur type et leur taille.
Ce type de certification est également essentiel pour vendre ou distribuer des dispositifs médicaux sur des marchés mondiaux tels que le Canada et l’UE. En effet, les fabricants certifiés ISO 13485 respectent les normes internationales, ce qui les rend conformes aux exigences spécifiques des pays.
Si les tiers fournissent la certification aux sociétés, aux entreprises et aux fabricants, ils ne peuvent pas délivrer directement la certification ISO 13485 aux particuliers. Toutefois, une certification d’auditeur ISO 13485 peut être accordée après avoir reçu une formation pertinente. Les auditeurs certifiés peuvent ensuite prendre en charge l’audit d’autres entreprises sur leur conformité à la norme.
Normalement, une certification ISO 13485 est valable jusqu’à 3 ans. En outre, des audits de surveillance annuels sont réalisés pour aider les organisations à suivre leurs progrès, ainsi qu’à vérifier si leurs processus actuels sont à jour et si les normes de qualité sont toujours respectées.
Outre la certification ISO 13485, les organisations du secteur des dispositifs médicaux sont également encouragées à être certifiées pour les normes ISO suivantes :



