Publication 26 Sept 2025
Article par
3 min de lecture
Qu’est-ce qu’une liste de contrôle MDR pour l’UE ?
Une liste de contrôle EU MDR est utilisée pour réglementer et documenter l’utilisation des dispositifs médicaux sur la base du règlement de l’Union européenne relatif aux dispositifs médicaux (EU MDR). Grâce à une liste de contrôle dédiée à l’EU MDR, vous pouvez vous assurer que vos dispositifs médicaux sont aptes à l’utilisation et à la distribution, depuis la fabrication jusqu’aux activités post-commercialisation.
Importance
Le respect européen relatif aux dispositifs médicaux nécessite de nombreux documents, inspections et systèmes, car il s’agit de dispositifs médicaux qui seront probablement utilisés pour des traitements vitaux et pour sauver des vies. Pour garantir le respect de toutes les exigences, il est essentiel de disposer d’une liste de contrôle pour l’EU MDR afin que toutes les étapes et tous les documents nécessaires soient respectés. Il répertorie toutes les tâches que vous devez accomplir au cours des processus de production et de distribution de vos dispositifs médicaux et vous aide à suivre et à signaler les problèmes qui peuvent survenir.
En outre, en définissant les exigences et les procédures à suivre pour se conformer aux normes MDR de l’UE, vous pouvez également garantir la sécurité sur le lieu de travail. Plus précisément, vous pouvez utiliser votre liste de contrôle pour aider vos fabricants et vos manipulateurs à identifier les risques potentiels associés à leurs dispositifs médicaux. Cette approche proactive permet de mettre en œuvre des mesures visant à atténuer les risques, à renforcer la sécurité globale des produits et à améliorer les processus existants.
La liste de contrôle sert également de base à la création et à l’organisation de la documentation nécessaire. Elle décrit les exigences en matière de documentation pour les dossiers techniques, les évaluations cliniques, la surveillance après la mise sur le marché et d’autres aspects cruciaux, garantissant ainsi que les fabricants conservent des dossiers complets.
Ce qu’il faut inclure dans une liste de contrôle EU MDR
Les différents dispositifs ont des objectifs différents, ainsi que des lignes directrices différentes à suivre dans le cadre du règlement MDR de l’UE. Toutefois, il serait préférable de disposer d’une liste de contrôle que vous pouvez utiliser quel que soit votre produit, ainsi que d’une liste spécifique à vos besoins.
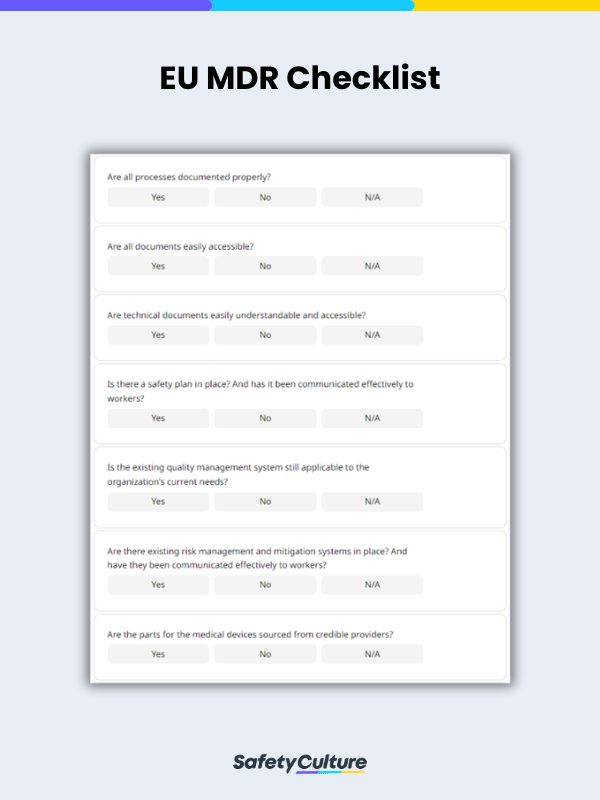
Votre liste de contrôle EU MDR à usage général doit comporter des champs pour les éléments suivants :
Date de l’audit
Type d’audit
Une section avec des sous-champs pour se conformer à des exigences telles que :
Documentation
Plans de sécurité
Systèmes de gestion de la qualité
Gestion des risques et plans d’atténuation
Approvisionnement adéquat en matériaux
Évaluations et essais cliniques appropriés
Présence et gestion de plans post-commercialisation
Une section pour l’audit des éléments, pièces et processus importants impliqués dans la fabrication et la distribution des dispositifs médicaux de votre organisation.
Autres notes et recommandations
Nom et signature de l’inspecteur
Voici un exemple de liste de contrôle UE MDR utilisée à titre de référence :

Liste de contrôle UE MDR – Exemple de rapport | SafetyCulture
Vous cherchez encore une liste de contrôle?
Créez un modèle de liste de contrôle personnalisé instantanément avec l'IA