Publication 27 Feb 2026
Article par
4 min de lecture
Qu’est-ce qu’une liste de contrôle ISO 14971 ?
Une liste de contrôle ISO 14971 est un formulaire basé sur les lignes directrices de l’ISO 14971, une norme internationale volontaire qui détaille la manière d’appliquer les pratiques de gestion des risques pour les dispositifs médicaux. Cette norme ISO a été élaborée par différents experts en médecine, en ingénierie et en gestion de la qualité.

Modèle de Liste de contrôle ISO 14971
Modèle de liste de contrôle ISO 14971 | SafetyCulture
Importance de l’ISO 14971
Alors queISO 14971est une norme volontaire, sa conformité garantit que de bons processus de fabrication sont suivis dans la création et la gestion des risques des dispositifs médicaux. Cependant, l’ISO 14971 est une norme en neuf parties, et s’y tenir peut être un défi. C’est pourquoi il peut être utile de disposer d’une liste de contrôle dédiée à la norme ISO 14971.
Disposer d’une liste de contrôle pour cette norme peut aider àrationaliser les flux de travail des fabricants de dispositifs médicauxcar il peut les aider à mieux identifier le cadre à utiliser pour l’analyse, l’évaluation, la révision et le contrôle des produits. Une liste de contrôle ISO 14971 peut également aider à contrôler la qualité de chaque étape ou phase du cycle de vie d’un dispositif médical, car elle peut aider à analyser les risques liés à la sécurité des données et des systèmes, à la gestion de l’électricité, aux rayonnements, à la biocompatibilité et à la convivialité générale.
Une liste de contrôle ISO 14971 peut également vous aider :
Identifier les problèmes liés à la gestion et à l’évaluation des risques
Respecter les normes internes et les autres normes ISO, telles que ISO 13485 qui décrit en détail la création et la distribution de dispositifs médicaux et de services connexes.
S’assurer que toutes les procédures appropriées pour la création et l’élimination des dispositifs médicaux et des pièces connexes sont respectées.
En suivant les lignes directrices de la gestion des risques, telles que celles deISO 31000
Ce qu’il faut inclure dans une liste de contrôle ISO 14971

Rapport type de la Liste de contrôle ISO 14971
Rapport type sur la liste de contrôle ISO 14971 | SafetyCulture
Avant toute chose, il convient de mettre en place un plan de gestion des risques que tous les employés devront suivre. Chaque dispositif médical et ses pièces doivent avoir leur propre plan de gestion des risques pour guider les employés sur la manière de gérer les risques à chaque étape de son cycle de vie. Le plan de gestion des risques doit également détailler les niveaux de risques acceptables ou gérables et doit être rassemblé dans un dossier de gestion des risques (RMF) pour un accès plus facile par la suite. La liste de contrôle ISO 14971 sera ensuite utilisée en conjonction avec les plans de gestion des risques en place.
Il existe de nombreuses façons de créer une liste de contrôle ISO 14971, car chaque fabricant a des procédures, des normes et des directives différentes. Cependant, une simple liste de contrôle ISO 14971 devrait idéalement contenir des sections pour les éléments suivants :
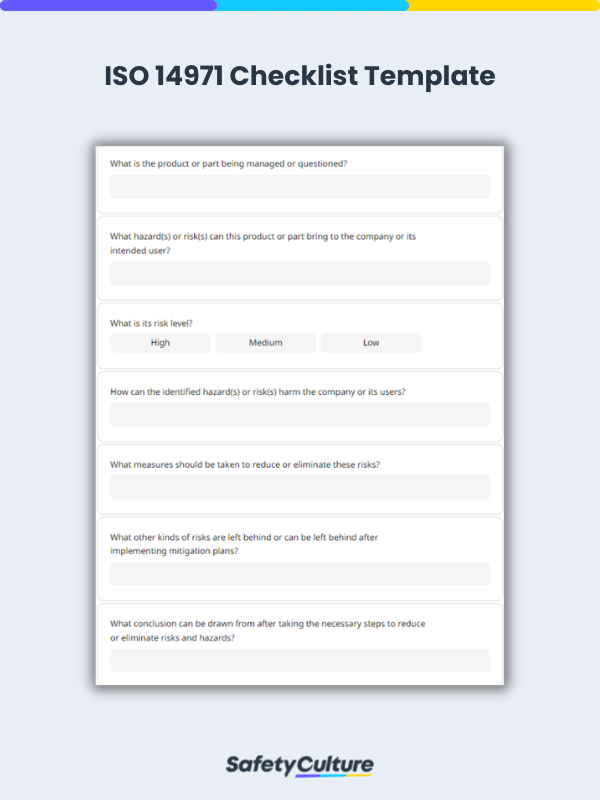
Description du produit : Quel est le produit ou la pièce géré(e) ou remis(e) en question ?
Analyse des risques : Quel(s) danger(s) ou risque(s) ce produit ou cette pièce peut-il apporter à l’entreprise ou à son utilisateur prévu ?
Évaluation des risques : Comment le ou les dangers ou risques identifiés peuvent-ils nuire à l’entreprise ou à ses utilisateurs ?
Contrôle ou atténuation des risques : Quelles sont les mesures à prendre pour réduire ou éliminer les risques ?
Évaluation du risque résiduel global : Quels sont les autres types de risques qui subsistent ou peuvent subsister après la mise en œuvre des plans d’atténuation ?
Examen de la gestion des risques : Quelle conclusion peut-on tirer après avoir pris les mesures nécessaires pour réduire ou éliminer les risques et les dangers ?
Examen post-production : Y a-t-il des recommandations concernant les futurs plans de gestion des risques, les utilisations et autres ?
Après avoir effectué une inspection de la gestion des risques, la liste de contrôle ISO 14971 doit être croisée avec les plans de gestion des risques. Il s’agit d’identifier d’autres risques et problèmes possibles dans la industrie, ainsi que de s’assurer que tous les plans appropriés ont été suivis.
Vous cherchez encore une liste de contrôle?
Créez un modèle de liste de contrôle personnalisé instantanément avec l'IA