Publicación 26 Sept 2025
Artículo de
2 min de lectura
¿Qué es el MDSAP?
El Programa de Auditoría Única de Dispositivos Médicos (MDSAP) es un programa de certificación para el Sistema de Gestión de Calidad (SGC) de los fabricantes que desean vender dispositivos médicos a los siguientes países participantes en el MDSAP: Estados Unidos, Australia, Japón, Brasil y Canadá.
Iniciado por el Foro Internacional de Reguladores de Dispositivos Médicos (IMDRF), el MDSAP pretende crear un proceso consolidado para mantener la seguridad y la calidad de los dispositivos médicos por parte de los fabricantes que cumplen con las normas internacionales de SGC (ISO 13485:2016) y cumplen con los requisitos de las Autoridades Reguladoras (AR) de los países participantes.
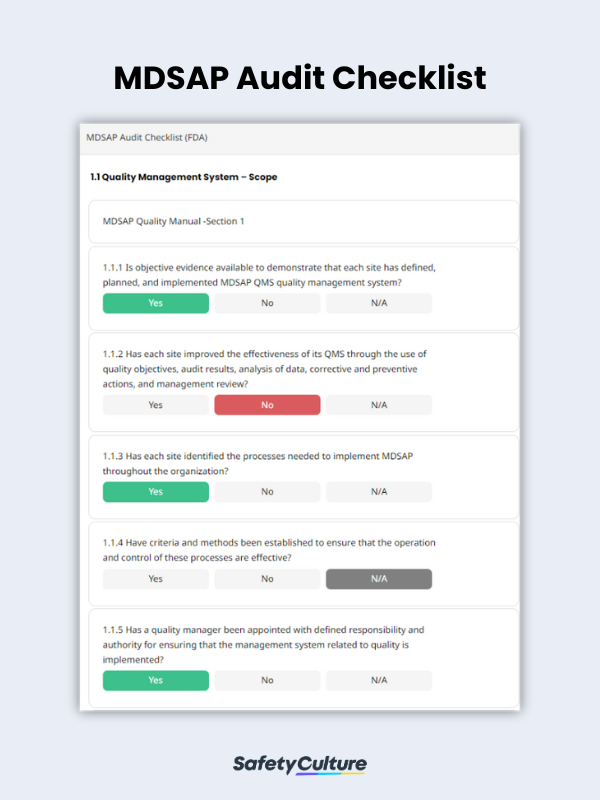
¿Qué son las listas de comprobación del Programa de Auditoría Única de Dispositivos Médicos?
Estas listas de comprobación son herramientas utilizadas por los responsables de calidad para determinar si el SGC del fabricante cumple los requisitos de la norma ISO 13485:2016 y los de las autoridades reguladoras. Las listas de comprobación de la auditoría MDSAP ayudan a los gestores de calidad a determinar el grado de preparación de los fabricantes de productos sanitarios para la certificación MDSAP por parte de Organizaciones Auditoras (OA) reconocidas.
6 pasos para preparar la certificación MDSAP
Conozca la norma ISO 13485:2016 y los requisitos de AR del país donde vaya a vender productos sanitarios.
Identificar las áreas de mejora en el actual SGC mediante la realización de un análisis de brechas o una auditoría de preparación para garantizar la adhesión a la norma ISO 13485:2016 y otros requisitos.
Llevar a cabo auditorías de control de calidad y mantener un registro de los resultados.
Defina las competencias de su organización y determine los requisitos de formación para la certificación MDSAP en función de los resultados de la auditoría.
Garantizar que se satisfagan las necesidades de competencia y que todas las partes implicadas estén al corriente.
Asociarse con una organización de auditoría para la certificación MDSAP.
¿Aún buscas una lista de verificación?
Crea una plantilla de lista de verificación personalizada al instante con IA